뉴스 정리
영국 의료기기법 (UK MDR)의 개정안이 발표 되었고, 곧 발효(2023년 7월 1일자)됩니다. AR업체인 MDSS에서 설명한 자료를 일부 발췌 번역하여 포스트 합니다.
https://www.legislation.gov.uk/uksi/2023/627/contents/made
영국 정부는 CE 인증서를 가진 의료기기들의 영국 시장 내 출시에 대한 과도 기간을 연장을 확정했습니다.
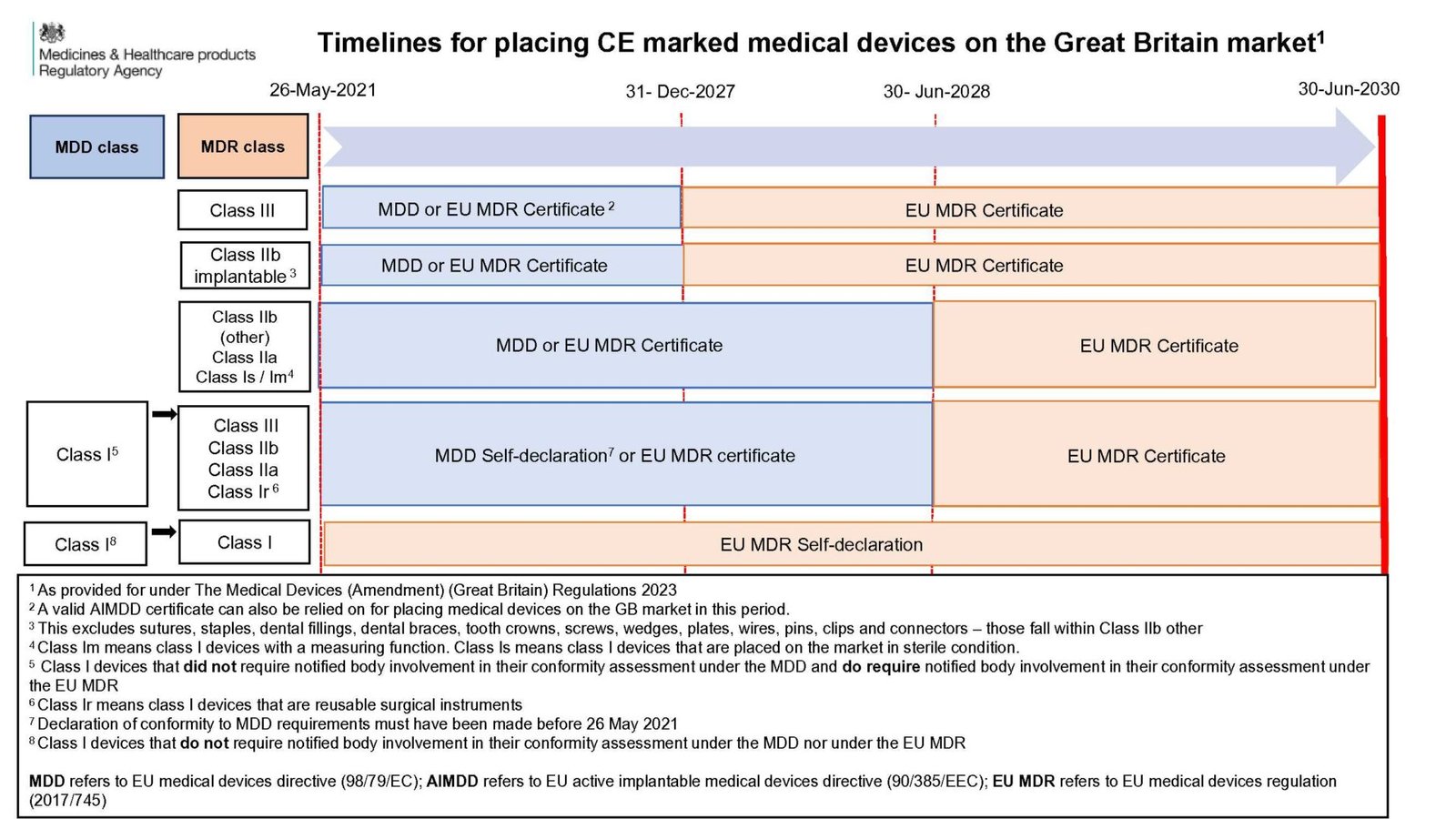
- 유효한 선언 및 CE 마크가 있는 EU MDD 이나 EU AIMDD를 준수하는 일반 의료기기는 인증서 만료일 전까지 혹은 2028년 6월 30일 이전까지 영국 시장에 계속 판매할 수 있습니다.
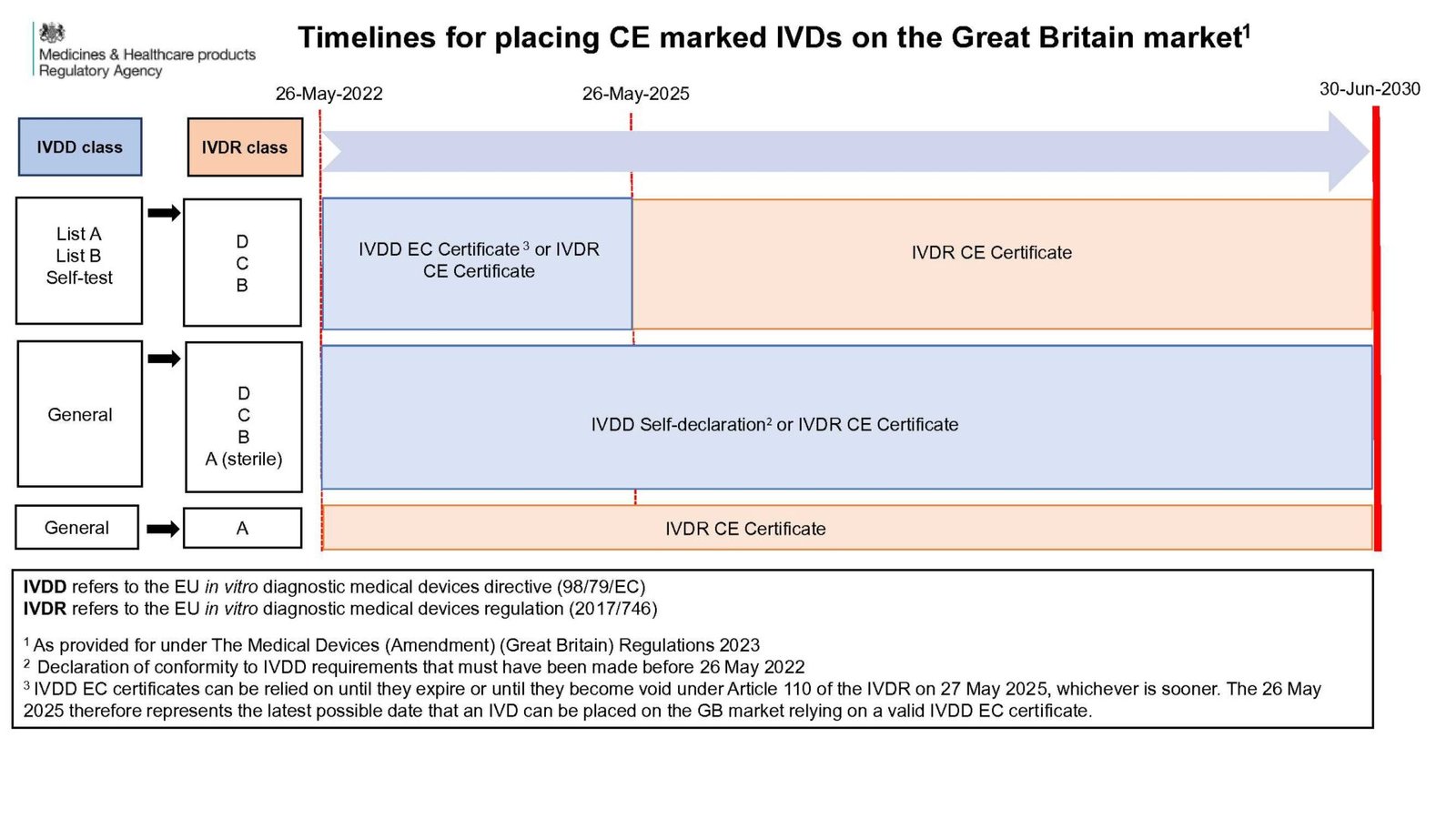
- EU IVDD을 준수하는 체외 진단 의료 기기(IVD)는 인증서 만료 또는 2030년 6월 30일 까지 영국 시장에서 계속 판매할 수 있습니다.
- EU MDR을 준수하는 주문 제작 기기를 포함한 일반 의료기기 및 EU IVDR을 준수하는 IVD는 2030년 6월 30일 까지 영국 시장에서 판매할 수 있습니다.
클래스 I 의료기기에 대해서는 아래와 같은 내용이 발효됩니다.
- EU MDR을 기준으로 자가 적합 선언을 한 경우에는 2030년 6월 까지 출시 및 판매 가능 합니다.
- 2021년 5월 26일 이전에 EU MDD에 따라 자체 선언했으며, 인증 기관(NB)이 EU MDD에 따라 평가하지 않지만, EU MDR에서는 인증기관 평가가 필요한 경우는 2028년 6월 30일까지 출시 및 판매가 가능합니다. 여기에는 등급이 없는 기기 및 재 사용 가능한 수술 기구가 포함됩니다.
- 2028년 6월 30일까지 유효한 EU MDD 인증서가 있는 살균 또는 측정 기능이 있는 클래스 I 의료 기기를 영국 시장에 출시 및 판매할 수 있습니다.
클래스 I 이고, EU MDD에서는 인증기관 심사가 필요 없지만, EU MDR에서는 인증기관 심사가 필요한 경우에는 이 조건 하에서만 출시 및 판매가 가능합니다.
맺음말
UKCA인증서를 발행할 수 있는 영국 인증 기관이 턱없이 부족하고, 시간도 너무 촉박해서 이런 조치가 나올 것이라고 기대는 하고 있었는데, 결국 다소 넉넉한 연장 기간이 부여가 되었습니다. EU MDR도 마찬가지 이지만, 새로운 법을 시행하기에 앞서 현실적인 문제가 계속 큰 걸림돌이 된 것 같습니다.
각국 제조사들에게는 매우 희소식이 될 것으로 보입니다만, MDD 기반 인증서는 더 이상 수정이 불가능하니 기능 변경이 발생할 경우엔 무조건 MDR 규정 하에서만 재인증이 되는 상황이라, 제품의 개선이나 새버전을 준비하는 업체들은 유예기간과 상관없이 MDR및 UK MDR인증에 사활을 걸어야 하지 않을까 생각됩니다.